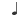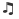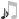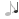Bir gazın hacmi sadece basınç ve hacim değil, aynı zamanda gaz miktarı ile de belirlenir. Miktar mol cinsinden verildiğinde, matematiksel ilişki

Burada n , gazın mol sayısını temsil eder. Bu ilişki Avogadro yasasıolarak biliniyor, çünkü 1811'de İtalya'dan Amedeo Avogadro, tüm gazların eşit hacimlerinin aynı sayıda molekülü içerdiğini öne sürdü. Teorisi, reaksiyonlardaki gaz hacimlerinin neden hidrojen yanmasında olduğu gibi küçük tamsayıların oranlarında olduğunu açıkladı:

Mole biriminin gözden geçirilmesinden önce, reaksiyon katsayılarının (önceki örnekte 2, 1 ve 2) molekül olarak veya mol olarak veya hacim olarak yorumlanabileceğini hatırlatmalısınız. Bunun nedeni, Avogadro yasasının tüm gazlar için tutulmasıdır. Bir gazın 1 molündeki molekül sayısının, Avogadro numarası olarak adlandırılan bir değer olan 6.02 x 10 23 olduğu bilinmektedir . Bu önemli sayının kullanımına örnek olarak, kütleyi tek bir oksijen atomunun gram cinsinden hesaplayın:
1 mol O 2 = 2 (16.00) = 32,00 gram


- Metan 10 gram, CH kaç hidrojen atomu vardır 4 ?